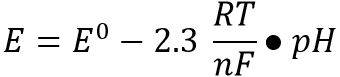اندازه گیری ph مواد از آنجایی که باید بطور دقیق انجام شود بسیار حائز اهمیت است! امروز در این مقاله به شما آموزش خواهیم داد که چگونه به روش های مختلف، خودتان ph مواد را محاسبه کنید.
مقادیر pH به چه منظور اندازه گیری میشوند؟
تعیین کیفی مقدار pH مواد غذایی احتمالاً قدیمی ترین تکنیک آنالیزی در جهان است. مواد غذایی به وسیله اندامهای چشایی تست می شوند. برخی از این مواد اسیدی و برخی دیگر قلیایی هستند. با استفاده از الکترودهای مدرن میتوان pH موادی که توسط حس چشایی اندازه گرفته میشوند را با ارقام دقیقتر اندازهگیری کرد؛ شما میتوانید انواع ph متر های پرتابل، رومیزی، قلمی و … را در سایت شرکت تجهیزات آزمایشگاهی آذین تجهیز مشاهده نمایید.
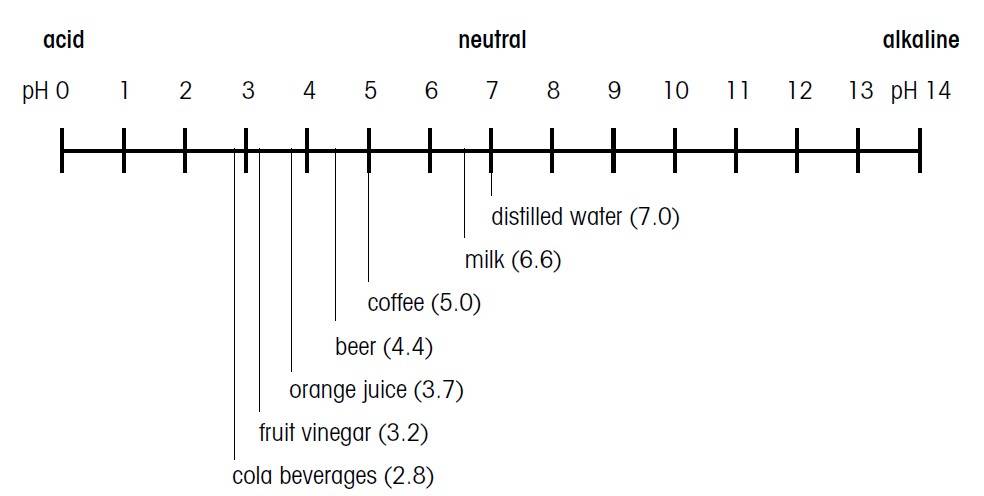
ph مواد غذایی مختلف
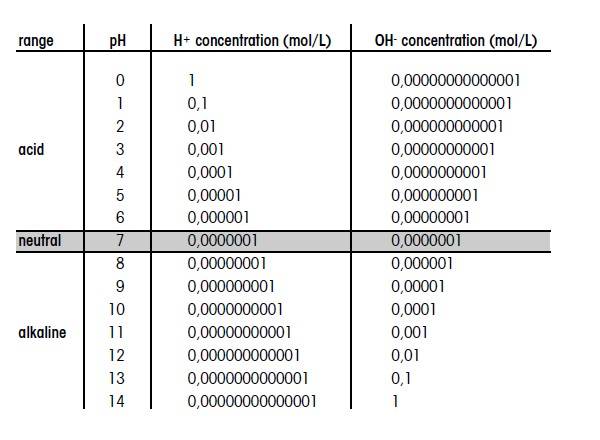
اسیدی یا قلیایی بودن یک محلول به غلظت یون هیدروژن (H با یون یکبار مثبت) موجود در آن بستگی دارد. در معادله سورنسون، PH به عنوان لگاریتم منفی غلظت یون هیدروژن در محلول موردنظر تعریف شده است. به عبارت دیگر، در غلظت بالا (حالت اسیدی) ، PH=0 ؛ و 10 به توان صفر = 1mol/L و در غلظت پایین (حالت بازی) PH=14 ؛ و 10 به توان منفی 14 = 1mol/L میباشد. بدین صورت مواد مختلف بطور عینی قابل مقایسهاند. در pH ،0 محیط بسیار اسیدی، در pH ،14 بسیار قلیایی و در pH ،7 محیط مورد نظر خنثی میباشد. در سالهای اخیر اندازه گیری pH اهمیت ویژهای یافته است. اندازه گیری و نظارت بر مقدار pH در کنترل و تنظیم فرآیندهای شیمیایی و بیولوژیکی ضروری است.
یکی از انواع ph متر، مدل inolab pH 7110 است که توسط کمپانی آلمانی WTW ساخته میشود. از مهمترین ویژگیهای این دستگاه میتوان به صفحه نمایش بزرگ با قابلیت نمایش همزمان pH و دما، امکان کالیبراسیون ۳ نقطهای، امکان محاسبه ۳ پارامتر pH، قابلیت تنظیم و اصلاح دمایی بصورت اتوماتیک و … اشاره کرد. ما در مقالهای اختصاصی، راهنمای دستگاه Inolab pH 7110 را برایتان شرح دادهایم که میتوانید آنرا مطالعه نمایید.
مزایای کنترل و اندازه گیری دقیق pH محیط
- تولید محصولاتی با ویژگیهای مشخص
- تولید محصولاتی با هزینه مقرون به صرفه
- جلوگیری از آسیب رسیدن به محیط زیست، انسان و متریالهای مختلف
- رعایت مقررات قانونی
- کسب اطلاعات بیشتر در زمینه تحقیق و پژوهش
مقیاس PH
مقادیر pH چگونه اندازه گیری میشود؟
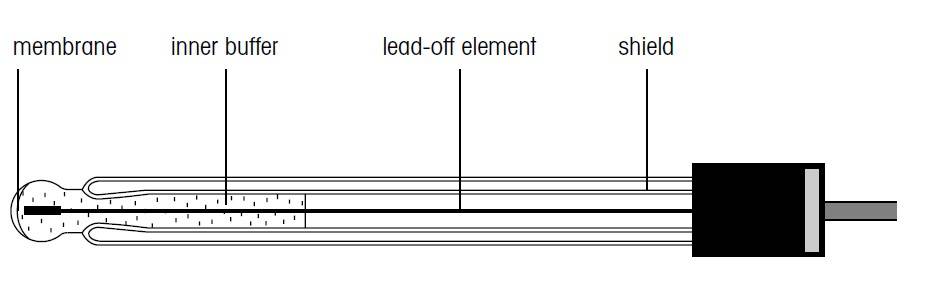
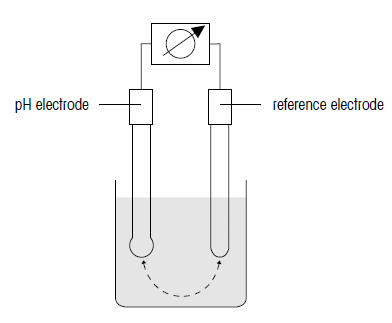
برای اندازه گیری مقدار pH، یک الکترود شناساگر (الکترود pH متر) و یک الکترود مرجع مورد نیاز است. در بسیاری موارد، اغلب الکترودهای ترکیبی که هر دو عناصر شناساگر و مرجع را در خود جای داده اند مورد استفاده قرار میگیرند.
الکترودهای شیشه ای
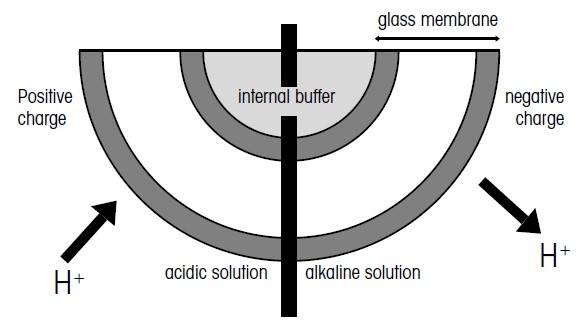
هنگام برخورد الکترودهای شیشه ای pH متر با محلول آبی مورد اندازه گیری، یک لایه ژلی بر روی غشای شیشه ای حساس به pH تشکیل میگردد. این لایه ژل که در داخل غشای شیشه ای ایجاد میشود با محلول بافر داخلی در تماس است.
با توجه به pH محلول موردنظر، یون های هیدروژن یک بار مثبت به بیرون از لایه ژلی منتشر شده و یا به درون آن انتقال مییابند. در محلول قلیایی (بازی) یون های هیدروژن یکبار مثبت به بیرون از لایه ژل منتشر شده و در قسمت بیرونی لایه ژلی منجر به ایجاد بار منفی میشوند. از آنجا که الکترود شیشه ای دارای یک بافر داخلی با pH ثابت است، پتانسیل غشاء کل با اختلاف پتانسیل داخلی و خارجی غشاء برابر است.
که در آن:
پتانسیل الکترود = Eel ؛ پتانسیل صفر = E0 ؛ شیب (mV در واحد pH) = S ؛ pH بافر داخلی = PHi ؛ pH محلول مورد اندازه گیری = PHa میباشند.
طرح کلی عملکرد غشاء شیشه ای
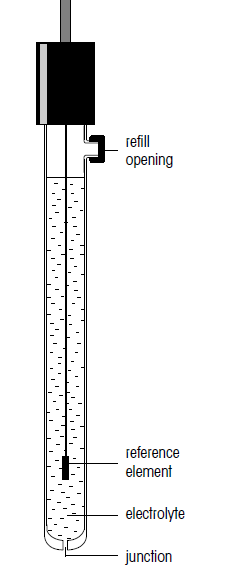
الکترودهای مرجع
مدار pH متر شامل یک الکترود اندازه گیری (الکترود شیشه ای) و یک الکترود مرجع است که هر دو در یک محلول غوطه ور شده اند. برای بدست آوردن مقدار pH، الکترود مرجع باید دارای پتانسیل پایدار و مشخصی باشد که این امر از محلول محاسبه شده مستقل است.
- بخوانید: ۲۴ کاربرد جالب اندازه گیری pH
هر الکترود مرجع شامل یک عنصر مرجع میباشد که در الکترولیت معینی غوطه ور است. الکترولیت همواره باید با محلول اندازه گیری شده در تماس باشد. این تماس بطور عمده از طریق نقطه اتصال سرامیکی متخلخل رخ میدهد. از بین شماری از سیستمهای مرجع، سیستمهای جیوه/کالومل و نقره/نقره کلرید با وجود اینکه دچار تغییرات بخصوصی نیز شدهاند، اهمیت کاربردی ویژهای یافتهاند. با این وجود امروزه به دلیل ملاحظات زیست محیطی، برای اندازه گیری ph، از الکترودهای جیوه ای به ندرت استفاده میشود. پتانسیل سیستم الکترود مرجع توسط الکترولیت مرجع (نقره/نقرهکلرید) تعیین میشود. بالا بودن غلظت یون در الکترولیت مرجع بسیار حائز اهمیت است؛ زیرا منجر به کاهش مقاومت الکتریکی میشود. در حالت ایده آل نباید هیچ واکنشی در طیف وسیعی از دما، بین الکترولیت مرجع و محلول مورد اندازه گیری رخ دهد.
برخی از محصولات ph متر (برای مشاهده کلیک کنید):
تستر pH مختص صنایع خاک و کشاورزی مدل HI98115 کمپانی Hanna آمریکا
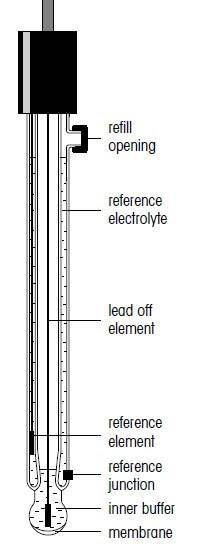
الکترودهای ترکیبی
استفاده از الکترود ترکیبی به علت کنترل آسانتری که نسبت به الکترودهای مجزا دارند رواج یافته است. در الکترودهای ترکیبی، الکترود شیشه ای بطور متمرکز توسط الکترولیت مرجع احاطه شده است. تنها در مواقعی که قسمتهای مختلف الکترود، میانگین عمر متفاوتی داشته باشند، استفاده از الکترودهای مجزا بجای یک الکترود ترکیبی در اندازه گیری ph مواد مختلف توصیه میشود.
الکترودهای سه در یک
یکی از نوآوری های اخیر افزودن سنسور دما به الکترودهای ترکیبی pH است. با قرار دادن سنسور دما در بدنه ای که pH و عناصر مرجع تعبیه شدهاند میتوان دما را به سادگی با بررسی سنسور مشاهده نمود.
ساختار الکترود ترکیبی
سیستم اندازه گیری pH
اندازه گیری موفق pH تنها با انتخاب سیستم مناسب برای برآوردن نیازهای نمونه میّسر است. همچنین انتخاب درست دستگاه و تهیه واکنش گرهای مناسب نیز بسیار حائز اهمیت است.
در انتخاب سیستم اندازه گیری pH موارد زیر باید مورد توجه قرار گیرد:
- مشخصات و سهولت کار با pH متر
- انتخاب الکترود مناسب حاوی سنسور دما
- بررسی نیاز به برقراری تعادل دمایی و استفاده از کاوشگر دما
- خالص و مناسب بودن مقدار محلول های بافر
- استفاده از واکنشگرهایی مانند آب مقطر
- محلول های الکترولیت و محلول های تمیزکننده
- استفاده از ظروف شیشه ای تمیز و برچسب گذاری شده
- نصب نگهدارنده الکترود
برای اندازه گیری بهینه pH، ابتدا باید الکترود مناسب انتخاب گردد. برای انتخاب الکترود موارد زیر در نظر گرفته میشود: ترکیب شیمیایی، همگنی، درجه حرارت، محدوده pH و اندازه محفظه (محدودیت طول و عرض). در نمونههای غیرآبی، کم رسانا، غنی از پروتئین و چسبناک که الکترودهای شیشه ای عموماً در معرض منابع مختلف خطا قرار دارند، انتخاب الکترود مناسب اهمیت ویژهای یافته است. سرعت پاسخگویی و دقت الکترود به عوامل مختلفی بستگی دارد. مدت زمان لازم برای اندازه گیری نمونه در pH و دمای بالا یا رسانایی پایین ممکن است بیشتر از زمان موردنیاز برای اندازه گیری محلول های آبی در دمای اتاق و pH خنثی باشد.
میزان دقت PH نمایش داده شده توسط الکترود به پایداری مداوم الکترود و همچنین عوامل آزمایشگاهی مانند دما، تمیز و تازه بودن محلول های بافر و حالت نمونه بستگی دارد. الکترود pH متر بوسیله نقطه صفر و شیب شناسایی میگردد. کالیبراسیون دو نقطه ای برای افزایش دقت اندازه گیری، به کار میرود.
مقادیر pH بدست آمده از الکترود بوسیله معادله نرنست تعریف میگردد.
در معادله فوق، E0 مقدار ثابت، R ثابت گاز، F ثابت فارادی، T دمای کلوین و n تغییرات یونی میباشد.
هنگام اندازه گیری یونهای هیدروژن (n=±1) در دمای 25˚C (298K)، ضریب شیب برابر با 59.16 mV است این مقدار، ضریب شیب ایده آل درنظر گرفته میشود. درنتیجه با تغییر یک واحد pH در سیستم اندازه گیری، ضریب شیب ایده آل به اندازه یک میلیولت تغییر می یابد. با اندازه گیری ضریب شیب، نحوه عملکرد سیستم الکترود مشخص میگردد.
درصورتی که الکترودها در دراز مدت پس از استفاده، پاکسازی و ضدعفونی نشوند، دقت سیستم به مرور تقلیل یافته و از بین میرود. اختلال عملکرد سیستم را میتوان با کاهش مداوم شیب کنترل کرد.
هنگامی که مقدار شیب به کمتر از 50 mV در هر دهه (85% بازده شیب) یا رانشی در نقطه صفر به ±30 mV برسد، این تغییر گسترده ممکن است عملکرد الکترودها را به سطح مطلوب بازگرداند، اما به منظور دست یابی به دقت بیشتر در اندازه گیری pH، تغییر الکترود ضروری است.
با این وجود باید به خاطر داشت که عواملی مانند انسداد محل اتصال مرجع، اتلاف الکترولیت، آلودگی لامپ شیشه ای و بکارگیری بافرهای نامناسب کالیبراسیون منجربه کاهش مقیاس شیب میشوند. در صورتی که در عملکرد سیستم pH اختلالی بوجود آید و از صحت pH بدست آمده اطمینان حاصل نشود موارد فوق باید به دقت مورد بررسی قرار گیرد.
اصلاح دما
اصلاح کننده خودکار دما (ATC) عموماً در آزمایشگاهها مورد استفاده قرار میگیرد بجز زمانیکه هم کالیبراسیون و هم مقدار pH در دمای ثابتی اندازه گیری شوند. در صورتی که اختلاف دمای نمونه و دمای کالیبراسیون بیش از 10˚C باشد، عدم وجود دمای مناسب منجربه ایجاد خطای 0.15 واحدی یا بیشتر در مقادیر بدست آمده از pH (مابین pH 3 و 11) میشود.
محدوده pH (0-14) به وسیله فرآورده یونی آب تعیین میگردد. آب تا حدودی به یونهای +H و -OH تجزیه میشود.
فرآورده یون I به شدت وابسته به دماست. دما بواسطه چهار عامل ذیل مقادیر pH را تحت تاثیر قرار میدهد:
- ضریب دمای محلول مورد اندازه گیری
- وابستگی دما به شیب (به معادله نرنست مراجعه شود)
- موقعیت تقاطع هم دما
- سرعت متفاوت واکنش الکترود (ناشی از تغییرات دما)
ضریب دما
هر محلولی دارای دما و pH (ضریب دما) مشخصی است. به دلیل وابستگی تفکیک مولکول ها به دما که باعث ایجاد تغییر در غلظت میشود. در نتیجه تغییر دما منجربه تغییر pH میگردد. این نوع تغییر واقعی بوده و خطای اندازه گیری بشمار نمی رود؛ بنابراین با استفاده از ATC نیز قابل اصلاح نیست.
در مقایسه مقادیر pH بدست آمده در دماهای مختلف، مورد فوق باید درنظر گرفته شود. عملاً نمونه ها باید در دمای یکسان اندازه گیری شوند.
وابستگی شیب به دما
در معادله ضریب شیب نرنست، عبارت دما نیز مشاهده میشود.
هنگام اندازه گیری pH، اثرات دما را میتوان به روشهای مختلفی کنترل و خنثی نمود. اکثر pH مترها دارای اصلاحگرهای دستی یا اتوماتیک دما (ATC) میباشند. دستگاه سنجش دما (ATC) برای اندازه گیری دما در بدنه الکترود pH نصب شده است. طبق معادله نرنست، ATC ها دمای محلول را اندازه گیری کرده و pH مترها میزان pH را به صورت الکترونیکی نمایش میدهند.
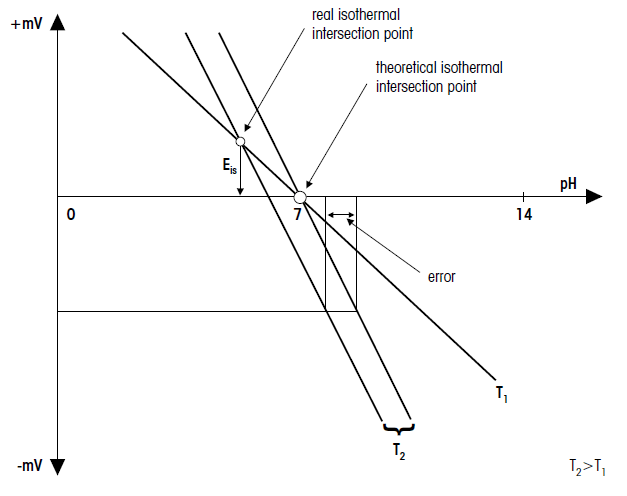
خط کالیبراسیون و تقاطع هم دما
در صورتی که خطوط کالیبراسیون (ایزوترمال) در نقطه صفر الکترود (pH 7=0 mV) در دماهای مختلف یکدیگر را قطع کنند، الکترود موردنظر دارای دمای ایدهآلی خواهد بود.
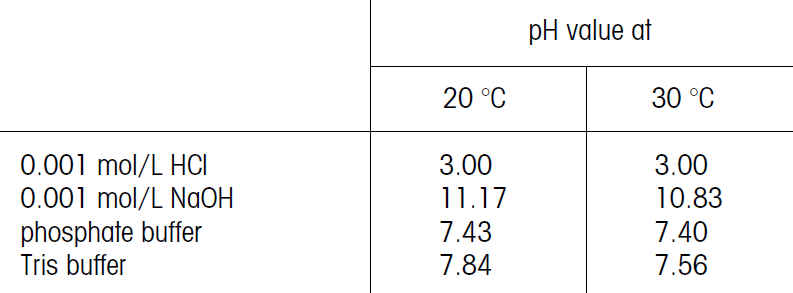
جدول تقاطع خطوط کالیبراسیون و نقاط ایزوترمال
از آنجا که پتانسیل کل الکترود pH از مجموع پتانسیل های منفرد تشکیل شده است و هر پتانسیلی وابستگیهای دمایی متفاوتی دارد. بنابراین تقاطع ایزوترمال به ندرت با نقطه صفر الکترود منطبق میشود (حالت ایده آل: 0 mV در pH=7/25˚C).
در چند سال اخیر، توسعه الکترود بر کاهش فاصله تقاطع ایزوترمال و نقطه صفر متمرکز شده است؛ زیرا با نزدیکشدن به pH 7، خطای دما کوچکتر میشود. با افزایش اختلاف دمای کالیبراسیون و محلولهای نمونه، خطای اندازهگیری افزایش مییابد. براساس قاعده کلی، خطاهای اندازه گیری عمدتاً در واحدهای 0.1 pH رخ میدهند. دقیقترین مقدار pH زمانی بدست میآید که دمای کالیبراسیون و محلولهای اندازهگیری شده یکسان باشد.
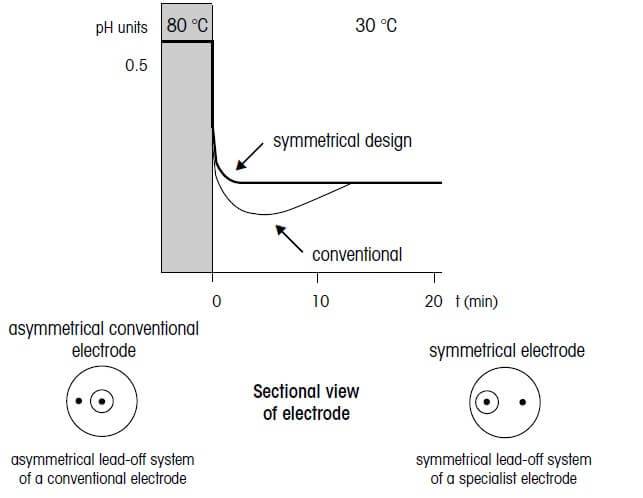
سرعت پاسخگویی الکترود
زمانی که دمای محیط سریعاً تغییر یابد، یک الکترود معمولی واحد دمای الکترود را تغییر داده و آنرا با محیط هم دما میسازد. به منظور افزایش سرعت واکنش الکترود ترکیبی نسبت به تغییرات دمایی محیط، دمای عنصر پیشگام داخلی و عنصر مرجع خارجی باید به صورت دائمی یکسان باشند. وابستگی دمایی عناصر پیشگام باید به طور متناوب برابر با صفر باشد.
الکترودهای مناسب برای اندازه گیری pH، در مرحله نخست از طریق افزایش یا کاهش متقابل دمای عناصر خروجی متمایز می شوند. این الکترودها در pH 7 و 0 mV دارای ضریب دما و تقاطع ایزوترمال یکسانی هستند؛ بنابراین پاسخگویی به تغییرات دمایی در کوتاه ترین زمان ممکن انجام میپذیرد.
عملکرد دمایی-زمانی الکترودهای ترکیبی
***
امیدواریم این مقاله به پیداکردن سوالات شما کمک کرده باشد! شرکت تجهیزات آزمایشگاهی آذین تجهیز در زمینه واردات و فروش انواع pH متر و تجهیزات آزمایشگاهی دیگر فعالیت دارد. برای خرید ph متر یا استعلام قیمت ph متر لطفاً با شماره های 02166578892 و 02166572995 تماس بگیرید. چنانچه سوالی درباره ph و اندازه گیری آن در ذهن دارید که تا اینجای مقاله به آن پاسخ داده نشده است میتوانید آنرا زیر همین نوشته برایمان ارسال کنید تا همکاران ما در اسرع وقت به آن پاسخ دهند.